


生物技术进展 ›› 2025, Vol. 15 ›› Issue (2): 276-286.DOI: 10.19586/j.2095-2341.2024.0208
• 研究论文 • 上一篇
张月秋1( ), 傅芳奇1(
), 傅芳奇1( ), 张华1, 陈一帆2, 王晨尧1, 蒋红叶1, 李亚辉3, 廖一尘1, 王丹1, 孙宇2, 付伟1(
), 张华1, 陈一帆2, 王晨尧1, 蒋红叶1, 李亚辉3, 廖一尘1, 王丹1, 孙宇2, 付伟1( ), 陈红1(
), 陈红1( )
)
收稿日期:2024-12-27
接受日期:2025-02-12
出版日期:2025-03-25
发布日期:2025-04-29
通讯作者:
付伟,陈红
作者简介:张月秋 E-mail: zhangyueqiu903@163.com;基金资助:
Yueqiu ZHANG1( ), Fangqi FU1(
), Fangqi FU1( ), Hua ZHANG1, Yifan CHEN2, Chenyao WANG1, Hongye JIANG1, Yahui LI3, Yichen LIAO1, Dan WANG1, Yu SUN2, Wei FU1(
), Hua ZHANG1, Yifan CHEN2, Chenyao WANG1, Hongye JIANG1, Yahui LI3, Yichen LIAO1, Dan WANG1, Yu SUN2, Wei FU1( ), Hong CHEN1(
), Hong CHEN1( )
)
Received:2024-12-27
Accepted:2025-02-12
Online:2025-03-25
Published:2025-04-29
Contact:
Wei FU,Hong CHEN
摘要:
转化体标准化检测方法为生物育种产业化的应用和定量标识制度实施提供了重要的技术支撑。基于插入序列左边界的信息,以耐除草剂大豆LP012-1转化体为研究对象,建立了实时荧光定量PCR(quantitative real-time PCR,qPCR)检测方法。以外源插入序列位点左边界为靶标序列设计引物及其相应的探针,筛选获得了最优的引物组合,并优化引物探针浓度和退火温度,确定线性动力学范围在0.018~100 ng,检出限和定量限分别为0.05%、0.10%;正确度、精密度、实验室内稳健性和实验室间的联合验证误差均小于25%。研究建立的qPCR检测方法特异性好、灵敏度高、稳健性强,可以为耐除草剂转基因大豆LP012-1的安全监管提供技术支撑,并服务于生物育种商业化。
中图分类号:
张月秋, 傅芳奇, 张华, 陈一帆, 王晨尧, 蒋红叶, 李亚辉, 廖一尘, 王丹, 孙宇, 付伟, 陈红. 转基因耐除草剂大豆LP012-1转化体实时荧光定量PCR检测方法的研究[J]. 生物技术进展, 2025, 15(2): 276-286.
Yueqiu ZHANG, Fangqi FU, Hua ZHANG, Yifan CHEN, Chenyao WANG, Hongye JIANG, Yahui LI, Yichen LIAO, Dan WANG, Yu SUN, Wei FU, Hong CHEN. Research of Detection Method for Genetically Modified Herbicide-tolerant Soyabean LP012-1 Transformant by Quantitative Real-time PCR[J]. Current Biotechnology, 2025, 15(2): 276-286.
| 样品 | 成分 | 混合方式 |
|---|---|---|
| 转基因大豆混合样 | 中黄6106、GTS40-3-2、MON89788、FG72、A5547-127、A2704-12、356043、305423、CV127、CAL16、MON87701、MON87708、MON87769、MON87705、DAS81419-2、DAS-444Ø6-6、MON87751、SHZD3201、DBN9004 | 转化体混合物质量分数为1% |
| 转基因玉米混合样 | MON810、MON863、GA21、NK603、Bt11、Bt176、T25、MON89034、MON88017、59122、MIR604、DBN9501、瑞丰125、MON87460、DAS40278-9、4114、MON87427、5307、3272、DBN9858、ND207、DBN9936、MON87411、MZIR098、浙大瑞丰8、BFL4-2、TC1507、nCX-1 | 转化体混合物质量分数为1% |
| 转基因水稻混合样 | TT51-1、KF-6、KMD-1、M12、KF-8、KF-2、G6H1、T1C-19 | 转化体混合物质量分数为1% |
| 转基因油菜混合样 | MS1、MS8、RF1、RF2、RF3、T45、Oxy235、Topas19/2、MON88302、73496 | 10个转化体混合物质量分数为1% |
| 转基因棉花混合样 | MON1445、MON531、MON15985、LLCOTTON25、MON88913、GHB614、COT102 | 转化体混合物质量分数为1% |
表1 混合样品成分表
Table 1 Components table of genetically modified mixed sample
| 样品 | 成分 | 混合方式 |
|---|---|---|
| 转基因大豆混合样 | 中黄6106、GTS40-3-2、MON89788、FG72、A5547-127、A2704-12、356043、305423、CV127、CAL16、MON87701、MON87708、MON87769、MON87705、DAS81419-2、DAS-444Ø6-6、MON87751、SHZD3201、DBN9004 | 转化体混合物质量分数为1% |
| 转基因玉米混合样 | MON810、MON863、GA21、NK603、Bt11、Bt176、T25、MON89034、MON88017、59122、MIR604、DBN9501、瑞丰125、MON87460、DAS40278-9、4114、MON87427、5307、3272、DBN9858、ND207、DBN9936、MON87411、MZIR098、浙大瑞丰8、BFL4-2、TC1507、nCX-1 | 转化体混合物质量分数为1% |
| 转基因水稻混合样 | TT51-1、KF-6、KMD-1、M12、KF-8、KF-2、G6H1、T1C-19 | 转化体混合物质量分数为1% |
| 转基因油菜混合样 | MS1、MS8、RF1、RF2、RF3、T45、Oxy235、Topas19/2、MON88302、73496 | 10个转化体混合物质量分数为1% |
| 转基因棉花混合样 | MON1445、MON531、MON15985、LLCOTTON25、MON88913、GHB614、COT102 | 转化体混合物质量分数为1% |
| 5′端引物和探针 | 序列(5′→3′) | 3′端引物和探针 | 序列(5′→3′) |
|---|---|---|---|
| LP012-1-LB-QF1 | 5′-TCCGCAATGTGTTATTAAG-3′ | LP012-1-RB-QF1 | 5′-CTGGAATAATCTCAATGACA-3′ |
| LP012-1-LB-QF2 | 5′-CGCAATGTGTTATTAAGTTG-3′ | LP012-1-RB-QF2 | 5′-CAAGCTGGAATAATCTCAA-3′ |
| LP012-1-LB-QR1 | 5′-CCTCTTCTTACTAATATTCCTTTA-3′ | LP012-1-RB-QF3 | 5′-AGCTGGAATAATCTCAATG-3′ |
| LP012-1-LB-QR2 | 5′-CTGGATCACAACTTACCTA-3′ | LP012-1-RB-QR1 | 5′-GCCTTCAGTTTAAACTATCA-3′ |
| LP012-1-LB-QP1 | 5′-FAM-TGCTCTGGATCACAACTTACCTAA-BHQ1-3′ | LP012-1-RB-QP1 | 5′-FAM-CTTCCACCGTTTCTGTTCCTTC-BHQ1-3′ |
| LP012-1-LB-QP2 | 5′-FAM-CACACTATGCCTGACCTATCTCA-BHQ1-3′ | LP012-1-RB-QP2 | 5′-FAM-CTGCTTCCACCGTTTCTGTTC-BHQ1-3′ |
| LP012-1-LB-QP3 | 5′-FAM-ACACTATGCCTGACCTATCTCAATT-BHQ1-3′ |
表2 LP012-1转化体实时荧光PCR检测引物探针序列信息
Table 2 The sequence of primers and probes for LP012-1 transformant qPCR
| 5′端引物和探针 | 序列(5′→3′) | 3′端引物和探针 | 序列(5′→3′) |
|---|---|---|---|
| LP012-1-LB-QF1 | 5′-TCCGCAATGTGTTATTAAG-3′ | LP012-1-RB-QF1 | 5′-CTGGAATAATCTCAATGACA-3′ |
| LP012-1-LB-QF2 | 5′-CGCAATGTGTTATTAAGTTG-3′ | LP012-1-RB-QF2 | 5′-CAAGCTGGAATAATCTCAA-3′ |
| LP012-1-LB-QR1 | 5′-CCTCTTCTTACTAATATTCCTTTA-3′ | LP012-1-RB-QF3 | 5′-AGCTGGAATAATCTCAATG-3′ |
| LP012-1-LB-QR2 | 5′-CTGGATCACAACTTACCTA-3′ | LP012-1-RB-QR1 | 5′-GCCTTCAGTTTAAACTATCA-3′ |
| LP012-1-LB-QP1 | 5′-FAM-TGCTCTGGATCACAACTTACCTAA-BHQ1-3′ | LP012-1-RB-QP1 | 5′-FAM-CTTCCACCGTTTCTGTTCCTTC-BHQ1-3′ |
| LP012-1-LB-QP2 | 5′-FAM-CACACTATGCCTGACCTATCTCA-BHQ1-3′ | LP012-1-RB-QP2 | 5′-FAM-CTGCTTCCACCGTTTCTGTTC-BHQ1-3′ |
| LP012-1-LB-QP3 | 5′-FAM-ACACTATGCCTGACCTATCTCAATT-BHQ1-3′ |
| 序号 | 组合(3′端) | 产物大小/bp | 序号 | 组合(5′端) | 产物大小/bp |
|---|---|---|---|---|---|
| 1 | LP012-1-LB-QF1/QR1/QP1 | 185 | 9 | LP012-1-LB-QF3/QR2/QP3 | 96 |
| 2 | LP012-1-LB-QF1/QR2/QP2 | 122 | 10 | LP012-1-LB-QF4/QR1/QP1 | 142 |
| 3 | LP012-1-LB-QF1/QR2/QP3 | 122 | 11 | LP012-1-RB-QF1/QR1/QP1 | 195 |
| 4 | LP012-1-LB-QF2/QR1/QP1 | 183 | 12 | LP012-1-RB-QF1/QR1/QP2 | 195 |
| 5 | LP012-1-LB-QF2/QR2/QP2 | 120 | 13 | LP012-1-RB-QF2/QR1/QP1 | 199 |
| 6 | LP012-1-LB-QF2/QR2/QP3 | 120 | 14 | LP012-1-RB-QF2/QR1/QP2 | 199 |
| 7 | LP012-1-LB-QF3/QR1/QP1 | 159 | 15 | LP012-1-RB-QF3/QR1/QP1 | 197 |
| 8 | LP012-1-LB-QF3/QR2/QP2 | 96 | 16 | LP012-1-RB-QF3/QR1/QP2 | 197 |
表3 LP012-1转化体实时荧光PCR检测引物探针组合信息
Table 3 The combination of primers and probes for LP012-1 transformant by qPCR
| 序号 | 组合(3′端) | 产物大小/bp | 序号 | 组合(5′端) | 产物大小/bp |
|---|---|---|---|---|---|
| 1 | LP012-1-LB-QF1/QR1/QP1 | 185 | 9 | LP012-1-LB-QF3/QR2/QP3 | 96 |
| 2 | LP012-1-LB-QF1/QR2/QP2 | 122 | 10 | LP012-1-LB-QF4/QR1/QP1 | 142 |
| 3 | LP012-1-LB-QF1/QR2/QP3 | 122 | 11 | LP012-1-RB-QF1/QR1/QP1 | 195 |
| 4 | LP012-1-LB-QF2/QR1/QP1 | 183 | 12 | LP012-1-RB-QF1/QR1/QP2 | 195 |
| 5 | LP012-1-LB-QF2/QR2/QP2 | 120 | 13 | LP012-1-RB-QF2/QR1/QP1 | 199 |
| 6 | LP012-1-LB-QF2/QR2/QP3 | 120 | 14 | LP012-1-RB-QF2/QR1/QP2 | 199 |
| 7 | LP012-1-LB-QF3/QR1/QP1 | 159 | 15 | LP012-1-RB-QF3/QR1/QP1 | 197 |
| 8 | LP012-1-LB-QF3/QR2/QP2 | 96 | 16 | LP012-1-RB-QF3/QR1/QP2 | 197 |
| 样品编号 | 反应体系中DNA含量/ng | 大豆Lectin基因拷贝数 | LP012-1转化体拷贝数 |
|---|---|---|---|
| G1 | 100.00 | 83 200.00 | 83 200.00 |
| G2 | 13.16 | 10 947.37 | 10 947.37 |
| G3 | 1.73 | 1 440.44 | 1 440.44 |
| G4 | 0.23 | 189.53 | 189.53 |
| G5 | 0.03 | 24.94 | 24.94 |
| G6 | 0.018 | 15.00 | 15.00 |
表4 耐除草剂大豆LP012-1转化体检测体系中校准品的DNA含量
Table 4 The DNA content of calibration standard sample of LP012-1 transformant
| 样品编号 | 反应体系中DNA含量/ng | 大豆Lectin基因拷贝数 | LP012-1转化体拷贝数 |
|---|---|---|---|
| G1 | 100.00 | 83 200.00 | 83 200.00 |
| G2 | 13.16 | 10 947.37 | 10 947.37 |
| G3 | 1.73 | 1 440.44 | 1 440.44 |
| G4 | 0.23 | 189.53 | 189.53 |
| G5 | 0.03 | 24.94 | 24.94 |
| G6 | 0.018 | 15.00 | 15.00 |
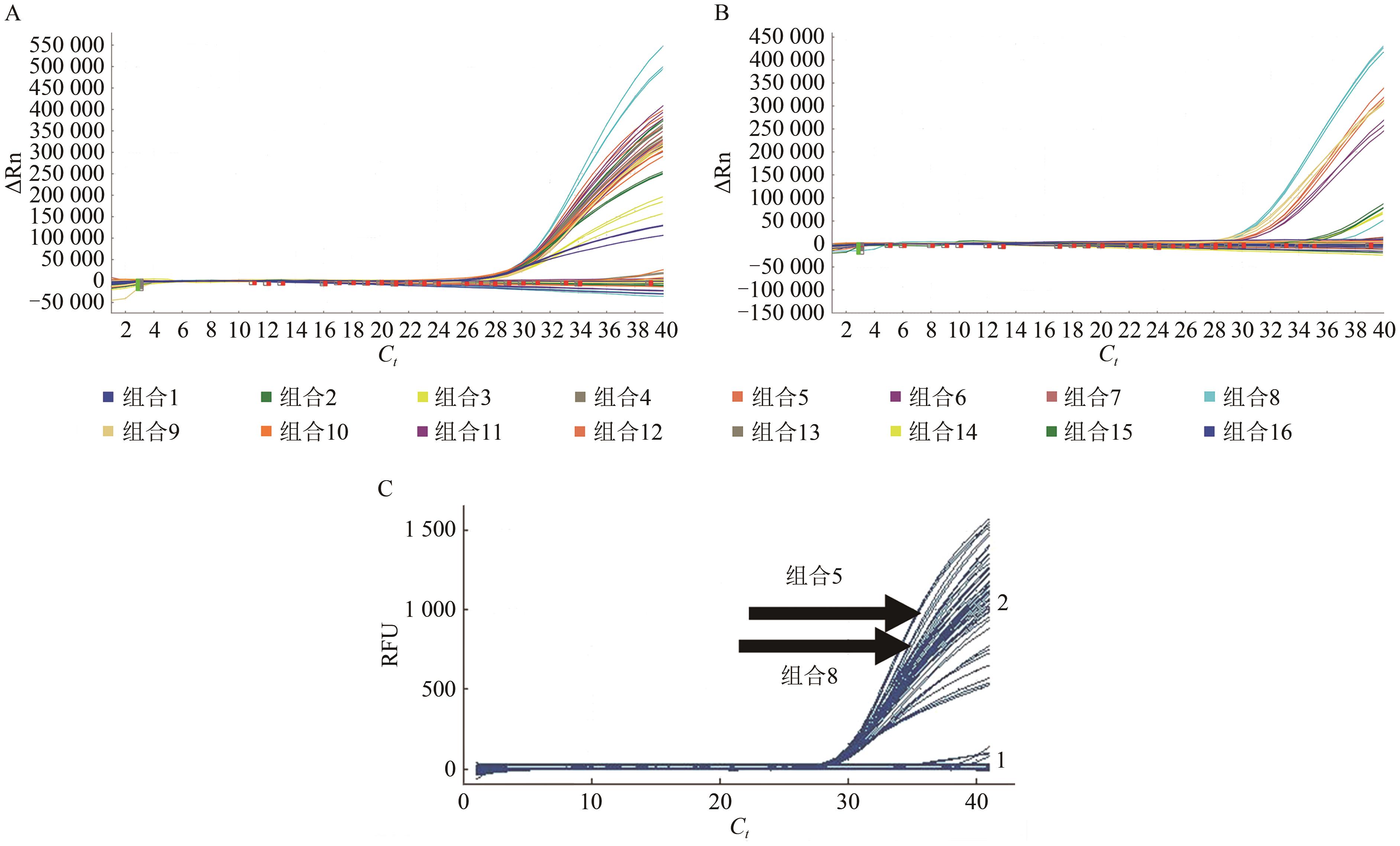
图1 LP012-1转化体的16对引物探针组合实时荧光PCR扩增结果A:Abi QuantStudio 3 PCR仪和TaKaRa的Premix Ex TaqTM(Probe qPCR)酶,B:Abi QuantStudio 3 PCR仪和ABi的TaqManTM Fast Advanced Master Mix酶;C: BIO-RAD CFX96 PCR仪和TaKaRa的Premix Ex TaqTM(Probe qPCR)酶。1—空白对照;2—1%的耐除草剂大豆LP012-1转化体模板DNA。
Fig. 1 qPCR amplification result of 16 primer and probe combinations of LP012-1 transformant
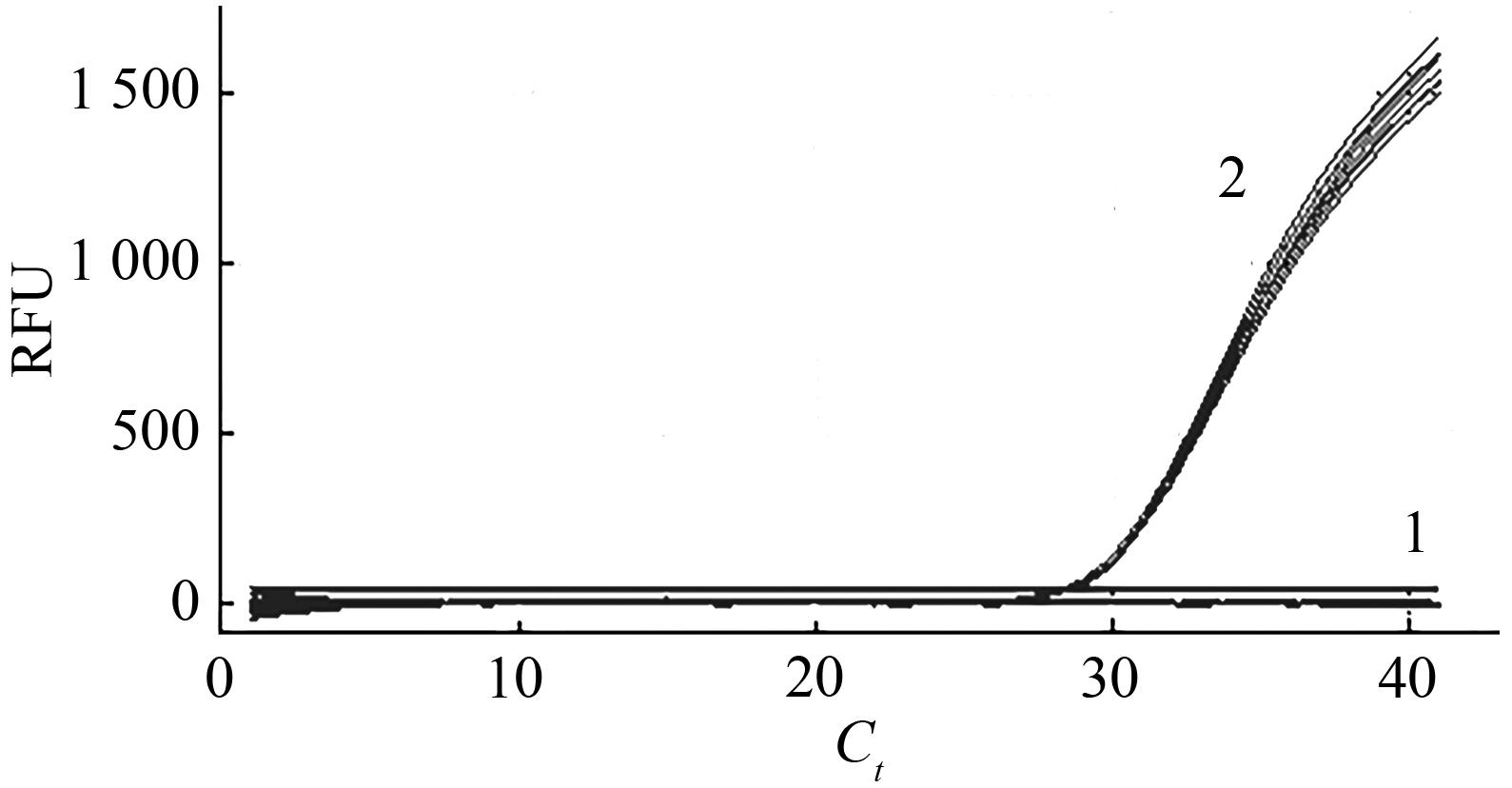
图2 LP012-1转化体实时荧光PCR检测方法特异性测试注:1—空白对照、阴性对照、表1中提到的其他转基因混合样;2—阳性对照、1%耐除草剂大豆LP012-1转化体。
Fig. 2 qPCR specific testing of detection method of LP012-1 transformant
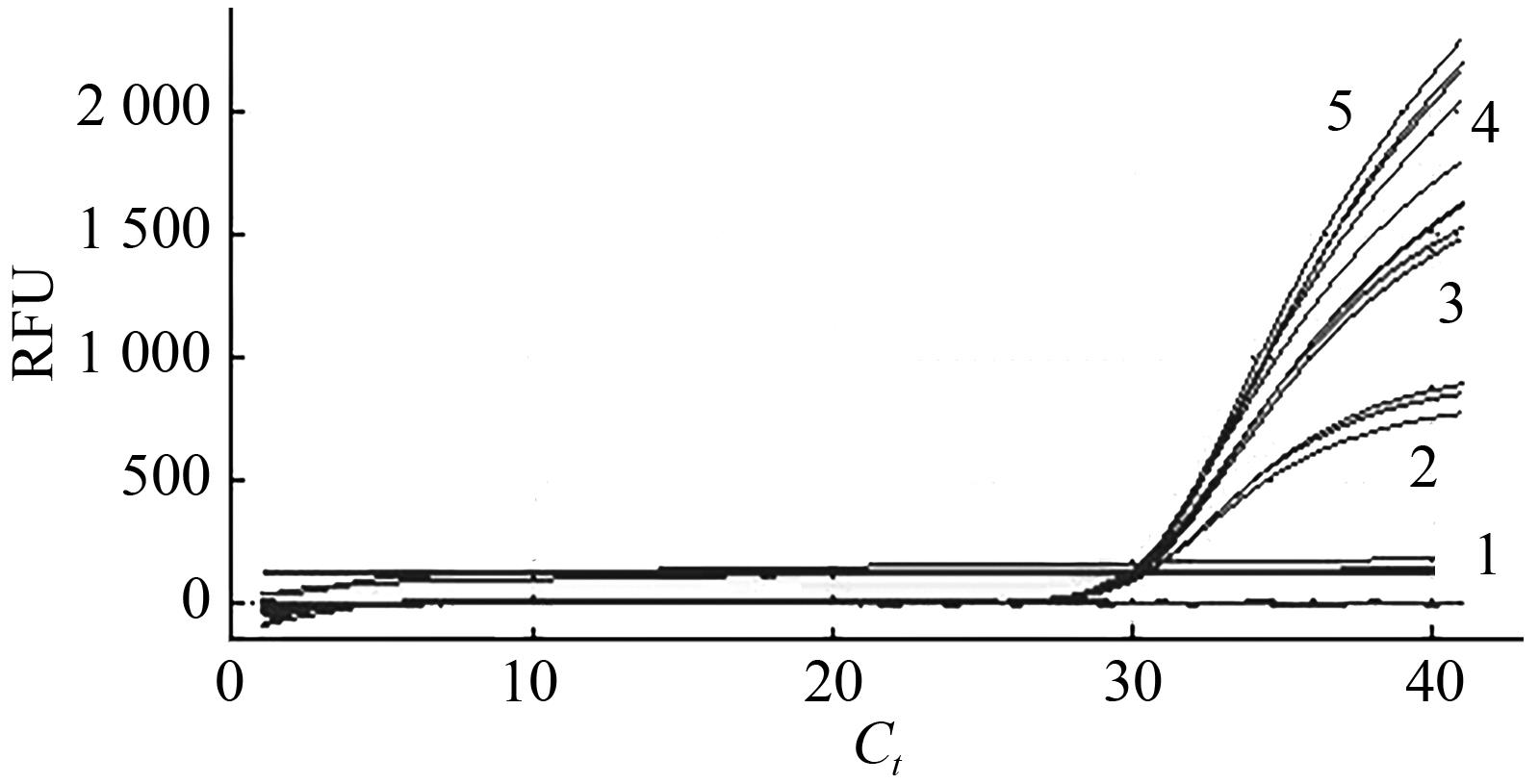
图3 LP012-1转化体和Lectin内标准基因实时荧光PCR引物探针浓度优化注:1—空白对照;2—0.2 μmol·L-1;3—0.4 μmol·L-1、阳性对照;4—0.6 μmol·L-1;5—0.8 μmol·L-1。
Fig. 3 qPCR of LP012-1 transformant and Lectin inner standard gene for optimization of primer and probe concentration
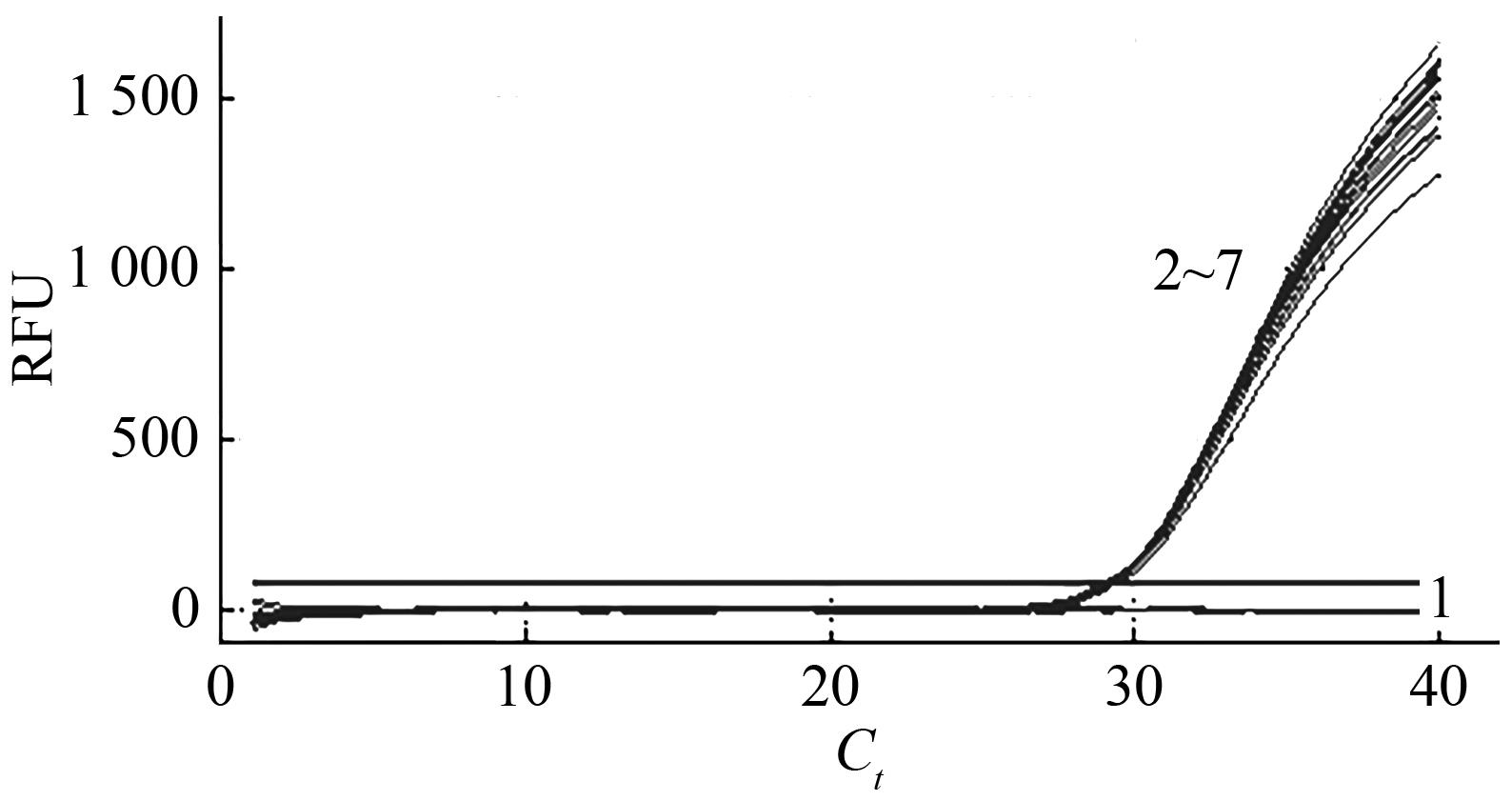
图4 LP012-1转化体退火温度优化注:1—空白对照;2—63.6 ℃;3—61.9 ℃;4—60.0 ℃;5—57.5 ℃;6—55.6 ℃;7—53.6 ℃。
Fig. 4 Annealing temperature of LP012-1 transformant for optimization
| 含量理论值 | 各平行子样转基因含量 | 平均值 | 相对偏倚 | 标准差 | 相对标准差 | ||
|---|---|---|---|---|---|---|---|
| 子样1 | 子样2 | 子样3 | |||||
| 5% | 4.44% | 4.66% | 5.51% | 4.87% | 2.63% | 0.63% | 12.90% |
| 1% | 1.14% | 0.89% | 1.11% | 1.05% | 4.34% | 0.15% | 14.11% |
| 0.1% | 0.11% | 0.11% | 0.10% | 0.11% | 4.93% | 0.01% | 10.06% |
表6 LP012-1转化体的精密和正确度度测试结果
Table 6 Test result of accuracy and precision of qPCR of LP012-1 transformant detection
| 含量理论值 | 各平行子样转基因含量 | 平均值 | 相对偏倚 | 标准差 | 相对标准差 | ||
|---|---|---|---|---|---|---|---|
| 子样1 | 子样2 | 子样3 | |||||
| 5% | 4.44% | 4.66% | 5.51% | 4.87% | 2.63% | 0.63% | 12.90% |
| 1% | 1.14% | 0.89% | 1.11% | 1.05% | 4.34% | 0.15% | 14.11% |
| 0.1% | 0.11% | 0.11% | 0.10% | 0.11% | 4.93% | 0.01% | 10.06% |
| 重复 | LP012-1转化体拷贝数 | Lectin基因拷贝数 | 百分比/% |
|---|---|---|---|
| 1 | 37 520.00 | 33.62 | 0.090 |
| 2 | 35 980.00 | 23.09 | 0.064 |
| 3 | 44 360.00 | 40.03 | 0.090 |
| 4 | 41 000.00 | 42.81 | 0.104 |
| 5 | 52 860.00 | 47.97 | 0.091 |
| 6 | 41 520.00 | 36.86 | 0.089 |
| 7 | 39 300.00 | 35.70 | 0.091 |
| 8 | 38 430.00 | 39.53 | 0.103 |
| 9 | 46 010.00 | 31.25 | 0.068 |
| 10 | 51 680.00 | 61.01 | 0.118 |
| 11 | 45 280.00 | 49.10 | 0.108 |
| 12 | 42 470.00 | 48.06 | 0.113 |
| 13 | 49 740.00 | 55.37 | 0.111 |
| 14 | 39 470.00 | 28.40 | 0.072 |
| 15 | 53 090.00 | 56.77 | 0.107 |
| 16 | 48 880.00 | 36.44 | 0.075 |
| 平均值 | 44 224 | 42 | 0.093 |
| 相对偏倚/% | - | - | -6.626 |
| 标准偏差/% | - | - | 0.017 |
| 相对标准偏差/% | - | - | 18.169 |
表7 LP012-1转化体实时荧光PCR方法定量限测试结果
Table 7 LOQ result of LP012-1 transformant by qPCR
| 重复 | LP012-1转化体拷贝数 | Lectin基因拷贝数 | 百分比/% |
|---|---|---|---|
| 1 | 37 520.00 | 33.62 | 0.090 |
| 2 | 35 980.00 | 23.09 | 0.064 |
| 3 | 44 360.00 | 40.03 | 0.090 |
| 4 | 41 000.00 | 42.81 | 0.104 |
| 5 | 52 860.00 | 47.97 | 0.091 |
| 6 | 41 520.00 | 36.86 | 0.089 |
| 7 | 39 300.00 | 35.70 | 0.091 |
| 8 | 38 430.00 | 39.53 | 0.103 |
| 9 | 46 010.00 | 31.25 | 0.068 |
| 10 | 51 680.00 | 61.01 | 0.118 |
| 11 | 45 280.00 | 49.10 | 0.108 |
| 12 | 42 470.00 | 48.06 | 0.113 |
| 13 | 49 740.00 | 55.37 | 0.111 |
| 14 | 39 470.00 | 28.40 | 0.072 |
| 15 | 53 090.00 | 56.77 | 0.107 |
| 16 | 48 880.00 | 36.44 | 0.075 |
| 平均值 | 44 224 | 42 | 0.093 |
| 相对偏倚/% | - | - | -6.626 |
| 标准偏差/% | - | - | 0.017 |
| 相对标准偏差/% | - | - | 18.169 |
| 因素 | 平行子样3次重复转化体拷贝数平均值与内标准基因拷贝数平均值比值% | 正确度% | 标准差% | 精密度% | ||||
|---|---|---|---|---|---|---|---|---|
| 子样1 | 子样2 | 子样3 | 子样均值 | 平均值 | ||||
| 其他操作者 | 0.11 | 0.10 | 0.11 | 0.11 | 0.11 | 5.17 | 0.006 | 6.16 |
| 0.11 | 0.10 | 0.12 | 0.11 | |||||
| 0.09 | 0.09 | 0.12 | 0.10 | |||||
| 其他试剂盒 | 0.11 | 0.11 | 0.12 | 0.11 | 0.11 | 9.99 | 0.005 | 4.26 |
| 0.10 | 0.12 | 0.10 | 0.11 | |||||
| 0.12 | 0.09 | 0.12 | 0.11 | |||||
| 其他仪器 | 0.08 | 0.12 | 0.10 | 0.10 | 0.10 | 1.33 | 0.004 | 3.89 |
| 0.10 | 0.11 | 0.09 | 0.10 | |||||
| 0.11 | 0.11 | 0.10 | 0.10 | |||||
表8 LP012-1转化体实时荧光PCR检测定量方法稳健性测试结果
Table 8 Robustness result of LP012-1 transformant by qPCR
| 因素 | 平行子样3次重复转化体拷贝数平均值与内标准基因拷贝数平均值比值% | 正确度% | 标准差% | 精密度% | ||||
|---|---|---|---|---|---|---|---|---|
| 子样1 | 子样2 | 子样3 | 子样均值 | 平均值 | ||||
| 其他操作者 | 0.11 | 0.10 | 0.11 | 0.11 | 0.11 | 5.17 | 0.006 | 6.16 |
| 0.11 | 0.10 | 0.12 | 0.11 | |||||
| 0.09 | 0.09 | 0.12 | 0.10 | |||||
| 其他试剂盒 | 0.11 | 0.11 | 0.12 | 0.11 | 0.11 | 9.99 | 0.005 | 4.26 |
| 0.10 | 0.12 | 0.10 | 0.11 | |||||
| 0.12 | 0.09 | 0.12 | 0.11 | |||||
| 其他仪器 | 0.08 | 0.12 | 0.10 | 0.10 | 0.10 | 1.33 | 0.004 | 3.89 |
| 0.10 | 0.11 | 0.09 | 0.10 | |||||
| 0.11 | 0.11 | 0.10 | 0.10 | |||||
| 实验室 | 不同含量样品标称转基因含量/% | ||||
|---|---|---|---|---|---|
| 5.0 | 3.0 | 1.0 | 0.5 | 0.1 | |
| 1 | 5.61 | 3.24 | 1.13 | 0.56 | 0.11 |
| 2 | 5.46 | 2.85 | 1.14 | 0.55 | 0.09 |
| 3 | 4.98 | 2.97 | 1.16 | 0.58 | 0.12 |
| 4 | 5.02 | 3.19 | 1.17 | 0.58 | 0.12 |
| 5 | 5.13 | 3.13 | 0.96 | 0.47 | 0.09 |
| 6 | 4.71 | 2.55 | 0.96 | 0.51 | 0.10 |
| 7 | 5.35 | 3.17 | 1.10 | 0.53 | 0.11 |
| 8 | 5.65 | 3.20 | 1.01 | 0.50 | 0.10 |
| RSD% | 6.98 | 8.48 | 8.49 | 8.31 | 11.24 |
表9 LP012-1转化体实时荧光PCR盲样检测结果
Table 9 Unknown sample test result of LP012-1 transformant by qPCR
| 实验室 | 不同含量样品标称转基因含量/% | ||||
|---|---|---|---|---|---|
| 5.0 | 3.0 | 1.0 | 0.5 | 0.1 | |
| 1 | 5.61 | 3.24 | 1.13 | 0.56 | 0.11 |
| 2 | 5.46 | 2.85 | 1.14 | 0.55 | 0.09 |
| 3 | 4.98 | 2.97 | 1.16 | 0.58 | 0.12 |
| 4 | 5.02 | 3.19 | 1.17 | 0.58 | 0.12 |
| 5 | 5.13 | 3.13 | 0.96 | 0.47 | 0.09 |
| 6 | 4.71 | 2.55 | 0.96 | 0.51 | 0.10 |
| 7 | 5.35 | 3.17 | 1.10 | 0.53 | 0.11 |
| 8 | 5.65 | 3.20 | 1.01 | 0.50 | 0.10 |
| RSD% | 6.98 | 8.48 | 8.49 | 8.31 | 11.24 |
| 1 | 中华人民共和国农业部. 转基因植物及其产品成分检测实时荧光定量PCR方法制定指南:农业部2259号公告—5—2015 [S].北京:中国农业出版社,2015. |
| 2 | 中华人民共和国农业部. 转基因植物及其产品成分检测大豆内标准基因定性PCR方法:农业部2031号公告—8—2013 [S].北京:中国农业出版社,2013. |
| 3 | 徐琳杰,刘培磊,李文龙,等.国际转基因标识制度变动趋势分析及对我国的启示[J].中国生物工程杂志,2018,38(9):94-98. |
| XU L J, LIU P L, LI W L, et al.. Analysis of the recent trends of international labeling policies for genetically modified products and the enlightenment to China's labeling management[J]. China Biotechnol., 2018, 38(9): 94-98. | |
| 4 | 黄耀辉,樊殿峰,焦悦,等.浅谈多国转基因产品标识制度对我国的启示[J].生物技术进展,2022,12(4):516-522. |
| HUANG Y H, FAN D F, JIAO Y, et al.. Enlightenment of GMO labeling system in other countries to China[J]. Curr. Biotechnol., 2022, 12(4): 516-522. | |
| 5 | 罗建兴,刘国强,呼李乐,等.转基因作物检测技术研究进展[J].食品安全质量检测学报,2023,14(15):139-148. |
| LUO J X, LIU G Q, HU L L, et al.. Research progress on detection technology of genetically modified crops[J]. J. Food Saf. Qual., 2023, 14(15): 139-148. | |
| 6 | 李凌燕,张旭冬,陈子言,等.转基因抗虫耐除草剂玉米MON87411精准定量检测方法的建立[J].生物安全学报,2023,32(1):38-45. |
| LI L Y, ZHANG X D, CHEN Z Y, et al.. Establishment of accurate quantitative detection method for insect-resistant and herbicide-tolerant maize MON87411[J]. J. Biosaf., 2023, 32(1): 38-45. | |
| 7 | 温洪涛,杨洋,丁一佳,等.转基因玉米MZIR098定量PCR检测方法的建立[J].计量学报,2023,44(3):430-439. |
| WEN H T, YANG Y, DING Y J, et al.. Establishment of quantitative PCR methods for the detection of genetically modified maize MZIR098[J]. Acta Metrol. Sin., 2023, 44(3): 430-439. | |
| 8 | 郑子繁,王颢潜,高佳奇,等.耐除草剂转基因大豆SHZD32-1数字PCR绝对定量方法的建立[J].计量学报,2023,44(3):415-421. |
| ZHENG Z F, WANG H Q, GAO J Q, et al.. Development of digital PCR absolute quantification method for herbicide-tolerant genetically modified soybean SHZD32-1[J]. Acta Metrol. Sin., 2023, 44(3): 415-421. | |
| 9 | 潘广,章桂明,黄新,等.应用双重数字PCR对转基因玉米成分进行定量方法研究[J].植物检疫,2016,30(3):65-71. |
| PAN G, ZHANG G M, HUANG X, et al.. Studies on quantification of transgenic maize ingredient with duplex droplet digital polymerase chain reaction[J]. Plant Quar., 2016, 30(3): 65-71. | |
| 10 | PINHEIRO L B, COLEMAN V A, HINDSON C M, et al.. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification[J]. Anal. Chem., 2012, 84(2): 1003-1011. |
| 11 | HINDSON B J, NESS K D, MASQUELIER D A, et al.. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number[J]. Anal. Chem., 2011, 83(22): 8604-8610. |
| 12 | 李亮,隋志伟,王晶,等.基于数字PCR的单分子DNA定量技术研究进展[J].生物化学与生物物理进展,2012,39(10):1017-1023. |
| LI L, SUI Z W, WANG J, et al.. Progress of digital PCR for single DNA quantification[J]. Prog. Biochem. Biophys., 2012, 39(10): 1017-1023. | |
| 13 | BHAT S, EMSLIE K R. Digital polymerase chain reaction for characterisation of DNA reference materials[J]. Biomol. Detect. Quantif., 2016, 10: 47-49. |
| 14 | 李达,王军,杨忠,等.核酸标准物质定值的实验体系研究[J].计量学报,2020,41(11):1436-1442. |
| LI D, WANG J, YANG Z, et al.. Experimental design analysis of developing quantitative nucleic acid reference materials[J]. Acta Metrol. Sin., 2020, 41(11): 1436-1442. | |
| 15 | 王迪,王志栋,吴枭,等.SARS-CoV-2基因组RNA标准物质的研制[J].计量学报,2021,42(2):259-264. |
| WANG D, WANG Z D, WU X, et al.. Development of reference material of SARS-CoV-2 genomic RNA[J]. Acta Metrol. Sin., 2021, 42(2): 259-264. | |
| 16 | 李亮.生物计量与标准物质:分析结果有效一致的保障[J].生物技术进展,2020,10(6):569. |
| LI L. Bio-metrology and reference materials: guarantee for validity and consistency of analytical results[J]. Curr. Biotechnol., 2020, 10(6): 569. | |
| 17 | 牛春艳,张永卓,杨佳怡,等.基于数字PCR的质粒核酸标准物质合作定值研究[J].计量学报,2021,42(11):1522-1527. |
| NIU C Y, ZHANG Y Z, YANG J Y, et al.. Resrach on the collaborative value assignment of plasmid nucleic acid refernce materials based on digital PCR[J]. Acta Metrol. Sin., 2021, 42(11): 1522-1527. | |
| 18 | 郑兰,杨立桃,王灿华.三种数字PCR平台对多靶标质粒标准物质的定值[J].农业生物技术学报,2017,25(9):1500-1507. |
| ZHENG L, YANG L T, WANG C H. Validation certified value of multi-targets plasmid reference materials by three digital PCR platforms[J]. J. Agric. Biotechnol., 2017, 25(9): 1500-1507. | |
| 19 | 赵新,刘双,刘娜,等.耐除草剂大豆'DBN9004'精准定量检测方法的建立[J].农业生物技术学报,2022,30(12):2446-2455. |
| ZHAO X, LIU S, LIU N, et al.. Establishment of accurate quantitative detection method for herbicide-tolerant soybean(Glycine max) 'DBN9004'[J]. J. Agric. Biotechnol., 2022, 30(12): 2446-2455. | |
| 20 | 肖芳,李俊,王颢潜,等.耐除草剂大豆'DBN9004'精准定量检测方法的建立[J].中国农业科学,2021,54(22):4728-4739. |
| XIAO F, LI J, WANG H Q, et al.. Establishment and application of a duplex ddPCR method to quantify the NK603/zSSIIb copy number ratio in transgenic maize NK603[J]. Sci. Agric. Sin., 2021, 54(22): 4728-4739. | |
| 21 | 白蓝,贾军伟,陈一帆,等.转基因抗除草剂大豆ZH10-6转化体特异性定量检测体系的建立[J].上海农业学报,2024,40(3):1-7. |
| BAI L, JIA J W, CHEN Y F, et al.. Establishing an specific quantitative detection system for transgenic herbicide-resistant soybean ZH10-6 transformant[J]. Acta Agric. Shanghai, 2024, 40(3): 1-7. | |
| 22 | 曹英芳,赵新,刘双,等.抗除草剂大豆GE-J12实时荧光定量PCR检测方法的建立[J].生物技术通报,2022,38(7):146-152. |
| CAO Y F, ZHAO X, LIU S, et al.. Establishment of real-time fluorescent quantitative PCR detection method for genetically modified herbicide-tolerant soybean GE-J12[J]. Biotechnol. Bull., 2022, 38(7): 146-152. |
| [1] | 张凤, 贺晓云, 黄昆仑, 汪其怀. 转基因耐除草剂大豆的食用安全评价研究进展[J]. 生物技术进展, 2021, 11(4): 489-495. |
| [2] | 缪青梅,赵杨,徐晓丽,徐俊锋,汪小福,陈笑芸. 转g10-epsps基因耐除草剂大豆ZUTS-33转化体特异性检测方法的建立[J]. 生物技术进展, 2020, 10(6): 696-703. |
| [3] | 刘晓,朱鹏宇,景小艳,李志红,张永江,李想,付伟,. 双重数字PCR在转基因大豆检测中的应用[J]. 生物技术进展, 2020, 10(1): 60-66. |
| [4] | 胡文冉,李晓东,周小云,李晓荣,杨洋,李波. 棉花GhCAD6基因表达及其功能分析研究[J]. 生物技术进展, 2019, 9(1): 46-53. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2021《生物技术进展》编辑部